¿Por
qué la taza no vuela hacia arriba?
¿Usted
en este momento está sentado frente a su escritorio con una taza de café caliente? Entonces no deseo que le suceda
lo siguiente: Usted sin querer le da un empujón a la taza y esta se cae y se
rompe, con lo cual el café se desparrama en la alfombra. Algo así es molesto,
pero posible y posiblemente ya le sucedió alguna vez.
¿Pero también le sucedió lo siguiente? El
café caliente, en la alfombra se enfría de repente. La energía liberada con
esto, la usa el café para fluir en dirección a la taza, la cual a su vez, también
se enfría y regresa junto con el café a la mesa. ¿Imposible dice usted? Desde el punto de vista energético es perfectamente
posible. Partamos de la base que el café al igual que la taza, se enfrían en 70°C,
entonces esto, aproximadamente correspondería a 1000 veces la energía necesaria
para regresar a la superficie de la mesa. Entonces la posibilidad existiría.
Pero esto es inverosímil. Tan poco probable,
que desde que existe el universo hasta ahora no ha sucedido en ninguna parte en
el universo. Por lo tanto junta a la energía debe existir otra magnitud, que determina el curso del
universo. A esta magnitud se le llama Entropía.
¿Qué es esta entropía y que efectos tiene? ¿Y
qué tiene que ver todo esto con la mecánica cuántica? Siga leyendo, en esta
secuencia vamos a tratar este tema.
La tercera teoría
Las teorías físicas
valen hasta que sean refutadas mediante experimentos. De esta manera, a comienzos del siglo pasado,
ensayos mostraron que la – actualmente llamada mecánica “clásica” – falla a
dimensiuoines muy pequeñas. Hace falta una nueva teoría, la mecánica cuántica.
Igualmente se mostró,
que la mecánica clásica no funciona cuando objetos se mueven a casi la
velocidad de la luz. La teoría de la relatividad de Einstein reemplaza aquí a
la mecánica clásica. Y a pesar de que ambas teorías no se pueden “unir” en una
nueva teoría, ambas son consideradas correctas.
Existe una tercera
importante teoría, que apareció hace unos 1oo años; la termodinámica. Esta teoría trata sobre la relación de las
propiedades de macros sistemas. Para esto se usan magnitudes como el calor, el
trabajo, la energía y también la entropía. Y también aquí vale: No hay nada que
habla contra de esta teoría. Con su
sistema de ecuaciones diferenciales parciales, es coherente en sí, y “matemáticamente
hermosa”.
Una para todo
La
termodinámico explica el desenvolvimiento de todos los fenómenos macroscópicos –
hasta el fin del universo – con cuatro leyes. La tal llamada ley 0 (cero)
define la medición de la temperatura. La primera ley no es otra cosa que la
conocida ley que aprendimos en los colegios, de la conservación de la energía: La
energía no se pierde y ni se crea y no pude ser creada de la “nada”. La segunda
y la tercera ley describen la entropía, aquella misteriosa magnitud, que por
ejemplo, determina el proceso de las reacciones químicas; que le pone un límite
natural al rendimiento de las máquinas térmicas y que impide que nuestra taza vuele.
¿Todo de nuevo desde el principio?
Hay tres
conceptos, para el entendimiento: El sistema, su entorno uy los procesos entre
ambos. El sistema – dicho de forma simple – es el, objeto observado (por
ejemplo, la taza con el café), que están en contacto con su entrono (el
universo restante). El sistema en determinados procesos puede intercambiar con
el entorno energía (calor, o trabajo) y también materia ¿Es posible revertir en
cualquier momento este cambio? ¿Puede
repetirse una uy otra vez siempre lo mismo?
En
caso afirmativo, entonces se habla de un proceso
reversible. Y aquí entra la entropía en el juego, Si se expresa el cambio
de la entropía del universo completo cómo ∆Suniv, como suma de la variación de la entropía del sistema ∆Ssyst y el entorno (el universo restante) como ∆SUmg (Syst, de System
= Sistema; Umg. De Umgebung = Entorno, el traductor), entonces para procesos
reversibles vale:
∆Suniv = ∆Ssyst + ∆SUmg = 0
Un
proceso sólo es reversible si elp sistema está constantemente en equilibrio con
el entorno, o sea, todos los procesos se desenvuelven en infinitos pequeños
pasos. Prácticamente esto significaría, que estos procesos se deberían
desarrollarse infinitamente lentos, anquen esta frase, en el “sentido termodinámico”
no es totalmente correcta, ya que se incluyó el tiempo. La taza se cae y sin
embargo se rompe de inmediato, entonces esto
es un proceso irreversible, que ya no es posible invertir. Aquí vale:
∆Suniv = ∆Ssyst + ∆SUmg > 0
Para
el total de la entropía con todos procesos (reversible e irreversible):
∆Suniv >= 0
La
entropía puede crearse en el universo pero jamás ser destruida.
Al final del universo
No
sólo gracias a Douglas Adams sabemos, lo que nos va a suceder cuando el
universo llega a su fin. También la termodinámica no hace una declaración: el
fin del universo es un estado de máxima entropía, la llamada “muerte térmica”.
Empero
la segunda ley aun tiene más consecuencias que la muerte térmica del universo y
la prohibición de vuelo de la taza., Una de las más importantes imposibilidades
es, construir una máquina térmica (calefactor, automóvil, refrigerador, …), que
no hace otra cosa que transformar calor en trabajo. En la conversión de calor Q
a trabajo W, siempre una parte del calor – con esto entropía – se traspasa a un reservorio más frío, más frío aquí significa
más frío que el sistema que hace el trabajo.
|
Reservorio de Calor Q1
Alta temperatura
|
W →
|
Trabajo realizado
|
↓
Q
|
Reservorio de calor Q2
Baja temperatura
|
¿Entropía, que cosa
eres?
Hasta el
momento, no nos podemos imaginar nada
ilustrativo sobre la entropía. Aquí
nos ayuda la, interpretación estadística de la termodinámica, que interpreta a
la entropía como un grado de desorden. Con esto se explica la muerte térmica
del universo como un estado de máximo desorden, donde toda la materia esta
uniformemente distribuida en el espacio, y donde también nuestro problema con
la taza con café se hace explicativo. El café en la taza, y la taza sobre e escritorio:
Un estado ordenado. Con el café en el suelo y la taza hecha añicos: Reina el
desorden.-
Para
que la taza vuelva a volar sobre la mesa, todos los átomos del café y de laña taza
deberían abandonar todo su movimiento térmico aleatorio, moverse en una determinada
dirección recomponerse en la taza con el café y luego volar sobre la mesa. Muy,
muy improbable.
¿Qué tiene que ver todo esto con la mecánica cuántica?
La termodinámica
no sólo es compatible con ello, sino incluso combinable. Una propia teoría, la termodinámica
estática, calcula las propiedades de sistema macroscópicos de las propiedades microscópicas
de las partículas individuales. Un
concepto central aquí es la función de partición Z, o sea, la suma
de todas las posibilidades de las energías cuanto-mecánicos Ej de un sistema:
De esta función de partición
Z en principio e pueden calcular todas las magnitudes de la termodinámica
cómo la energía o entropía
¿No hay peculiaridades de
la mecánica cuántica en la termodinámica?
¡Claro que sí! Esto lo
muestra un modelo teórico presentado hace poco, por el físico Marlan O. Scull
de la Texas A&M University [1]. Acordémonos de las arriba descritas máquinas.
El
mejor grado de efectividad teórico de un motor térmico se puede expresar, como
consecuencia de la segunda ley de la termodinámica, de la siguiente manera:
El grado de rendimiento sólo está determinado
por la diferencia de temperatura entre
el reservorio caliente y reservorio el
frio. Un reservorio térmico individual aislado nunca podrá realizar un trabajo,
siempre debe desviarse una a parte del
calor a un reservorio más frio. Si ambos reservorios térmicos tienen la misma
temperatura, el grado de efectividad es igual
a cero.
Scully presentó ahora un enfoque teórico que
podría romper el tal llamado “Carnot – Limit”: el presentado reversible y cerrado proceso trabaja en forma más
eficiente según lo permitido por Carnot. Su “máquina a vapor accionada por fotones”, con el aprovechamiento de la coherencia mecánica-cuántica, puede producir
trabajo e un único reservorio térmico.
El rol del vapor lo toman los fotones, el reservorio térmico se compone de
átomos calientes que por procesos de emisión y absorción intercambian emergía
con los fotones. Sí en los átomos calientes se genera coherencia cuántica, la
radiación de los fotones (“vapor”) la temperatura característica Tp puede
ser distinta de Th. Por esta razón en el caso de Th = Tt’, o sea, de sólo un reservorio
térmico se puede generar trabajo.
¿Y la
segunda ley?
Vale igual que antes, también en la mecánica cuántica.
El experimento no lesiona la validez, puesto que la generación de la coherencia
cobra energía y entropía adicional. Todo el sistema de entropía también aumenta
en el caso de una máquina a vapor por fotones. Lo especial de esto es que erl
trabajo es realizada por un único reservorio térmico.
Con esto sería pensable, que una máquina
térmica cuántica, cómo “post quemador cuántico” aumente algún día la eficacia
de los motores térmicos.
Autor
Günter Storm
Traducido
del alemán por A. Gundelach, marzo 2014
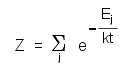
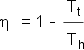



















No hay comentarios.:
Publicar un comentario